Employee learning 员工学习当前位置: 首页> 新闻动态> 员工学习
- 有机硅行业—员工学习小知识(一)
- 发布时间: 2018-08-15 点击次数:6842
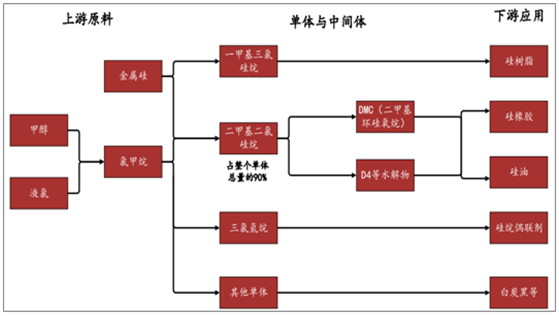
有机硅产业链概况
多晶硅产业现状
太阳能电池市场现状
煤炭石油是两大不可再生能源。上个世纪发生的两次石油危机,一方面是对世界经济的极大冲击,但同时也是一次机遇,再加上保护环境,开发绿色能源、替代能源,已被人们预测为改变我们未来10年生活的十大新科技之一。在未来10年内,风力、阳光、地热等替代能源可望供应全世界所需能源的30%。
由于太阳能发电具有充分的清洁性、绝对的安全性、资源的相对广泛性和充足性、长寿性以及免维护性等其它常规能源所不具备的优点,所以光伏能源被认为是二十一世纪最重要的新能源。
硅及其硅的氯化物的简介
一、硅的简介
硅,1823年发现,为世界上第二最丰富的元素——占地壳四分之一,砂石中含有大量的SiO2,也是玻璃和水泥的主要原料,纯硅则用在电子元件上,譬如启动人造卫星一切仪器的太阳能电池,便用得上它。
硅,由于它的一些良好性能和丰富的资源,自一九五三年作为整流二极管元件问世以来,随着硅纯度的不断提高,目前已发展成为电子工业及太阳能产业中应用最广泛的材料。
多晶硅的最终用途主要是用于生产集成电路、分立器件和太阳能电池片的原料。

1.硅的物理性质
硅有晶态和无定形两种同素异形体,晶态硅又分为单晶硅和多晶硅,它们均具有金刚石晶格,晶体硬而脆,具有金属光泽,能导电,但导电率不及金属,具有半导体性质,晶态硅的熔点1416±4℃,沸点3145℃,密度2.33g/cm3莫氏硬度为7。
单晶硅和多晶硅的区别是,当熔融的单质硅凝固同时,硅原子以金刚石晶格排列为单一晶核,晶面取向相同的晶粒,则形成单晶硅,如果当这些晶核成长成晶面取向不同的晶粒,则形成多晶硅,多晶硅与单晶硅的差异主要表现在物理性质方面。
一般的半导体器件要求硅的纯度六个9以上,大规模集成电路的要求更高,硅的纯度必须达到九个9。
2.硅的化学性质
硅在常温下不活泼,其主要的化学性质如下:
(1)与非金属作用
常温下Si只能与F2反应,在F2中瞬间燃烧,生成SiF4
Si+2F2=SiF4
加热时,能与其他卤素反应生成氯化硅,与氧气生成SIO2.
Si+2X2=SiX4(X=Cl,Br,I)
Si+O2=SiO2
在高温下,硅与碳、氮、硫等非金属单质化合,分别生成碳化硅SiC,氮化硅Si3N4,和硫化硅SiS2等。
(2)与酸作用
硅在含氧酸中被钝化,但与氢氟酸及其混合酸反应,生成SiF4或H2SiF6(偏硅酸)。
Si+4HF=SiF4+2H2
Si+4HNO3+6HF=H2SiF6+4NO2+4H2O
(3)与碱作用
无定形硅能与碱猛烈反应生成可溶性硅酸盐,并放出氢气。
Si+2NaOH+H2O=Na2SIO3+2H2↑
(4)与金属作用
硅还能与钙、镁、铜、铁、铂、铋等化合,生成相应的金属硅化物。
二、硅的氯化物
硅的氯化物主要介绍SiCl4、SiHCl3等,它们和碳的卤化物CF4和CCl4相似,都是四面体的非极性分子,共价化合物,溶沸点都比较低,挥发性也比较大,易于用蒸馏的方法提纯它们。
在常温下,纯净的SiCl4、SiHCl3是无色透明的易挥发液体。
1.氯硅烷的物理性质
在常温下,纯净的SiCl4、SiHCl3是无色透明挥发性的液体,SiHCl3比SiCl4具有更强的刺鼻气味。
SiCl4:沸点为57.6℃,分子量170,液体密度1.47 g/cm3
SiHCl3:沸点为31.8℃,分子量135.45,液体密度1.32 g/cm3
2.化学性质
a.易水解、潮解,在空气中强烈发烟
易水解、潮解:
SiCl4+(n+2)H2O→SiO2·nH2O+4HCl
SiHCl3+nH2O→SiO2·nH2O+3HCl
b.易挥发、易气化、易制备、易还原。
c.SiHCl3易着火,发火点28℃,燃烧时产生HCl和Cl2,着火点为220℃。
d.对金属极为稳定,甚至对金属钠也不起反应。
e.其蒸汽具有弱毒性,与无水醋酸及二氮乙烯的毒性程度极为相同。
SiHCl3
SiHCl3还原制备超纯硅的方法,在生产中被广泛的应用和迅速发展。因为他容易制得,解决了原料问题,容易还原成单质硅,沉积速度快,解决了产量问题,它的沸点低,化学结构的弱极性,使得容易提纯,产品质量高,利用它对金属的稳定性,在生产中常用不锈钢作为材质。但有较大的爆炸危险,因此在操作过程中应保持设备的干燥和管道的密封性,如果发现微量漏气,而不知道在什么地方时,可用浸有氨水的棉球接近待查处,若有浓厚白色烟雾就可以断定漏气的地方。
原理如下:
2HCl+2NH4OH→2NH4Cl+H2O
- 上一篇:重磅! 2019年1月1日起税务局全面征收社保
下一篇:浅析硅氢加成中催化剂的选用 - 返回新闻列表
